La (seria pero divertida) historia de la tabla periódica en su 150 aniversario
La Organización de las Naciones Unidas proclama 2019 como el Año Internacional de la Tabla Periódica

Tabla espiral de Theodor Benfey’s (1964). / DePiep / Wikimedia Commons, CC BY-SA
La tabla periódica está presente en las paredes de casi todos los laboratorios de química. El mérito de su creación se le otorga habitualmente a Dmitri Mendeléyev, un químico ruso que en 1869 escribió en tarjetas todos los elementos conocidos (63 hasta ese momento) y después los organizó en columnas y filas de acuerdo a sus propiedades químicas y físicas. Para celebrar el 150 aniversario de este momento clave para la ciencia, la Organización de las Naciones Unidas ha proclamado 2019 como el Año Internacional de la Tabla Periódica.
Pero la tabla periódica no empezó con Mendeléyev. Antes que él, muchos habían ensayado sus propias tablas de elementos. Décadas antes, el químico John Dalton intentó crear una tabla y algunos símbolos interesantes para identificar los elementos, pero no parecieron ser de su agrado. Tan solo unos años antes de que Mendeléyev se sentase con su baraja de cartas caseras, John Newlands creó también una tabla en la que clasificó los elementos según sus propiedades.
La genialidad de Mendeléyev reside en lo que dejó fuera de su tabla. Supo reconocer que ciertos elementos no estaban presentes ya que aún tenían que ser descubiertos, así que donde Dalton, Newlands y otros habían expuesto lo que se sabía, él dejó espacio para lo desconocido. Además, tuvo la capacidad de predecir, de manera aún más asombrosa, las propiedades de los elementos que faltaban.

La tabla de Dmitri Mendeléyev completa (sin los elementos aún por descubrir). / Wikimedia Commons

La tabla de Dmitri Mendeléyev completa (sin los elementos aún por descubrir). / Wikimedia Commons
Fíjese en los signos de interrogación de la tabla situada justo encima de estas líneas. Por ejemplo, al lado del elemento “Al” (aluminio) hay espacio para un metal desconocido. Mendeléyev predijo que el potencial descubrimiento tendría una masa atómica de 68, una densidad de seis gramos por centímetro cúbico y un punto de fusión muy bajo. Seis años después, Paul Émile Lecoq de Boisbaudran aisló el galio, que encajaba a la perfección en el espacio dispuesto con una masa atómica de 69,7, una densidad de 5.9g/cm³ y un punto de fusión tan bajo que se convierte en líquido en la mano. Mendeléyev hizo lo mismo con el escandio, el germanio y el tecnecio (que no fue descubierto hasta 1937, 30 años después de la muerte del científico ruso).
A primera vista, la tabla de Mendeléyev no se parece demasiado a la tabla con la que estamos familiarizados. Uno de los motivos es que la tabla periódica moderna contiene varios elementos que Mendeléyev pasó por alto y para los que no dejó espacio, especialmente los gases nobles (como el helio, el neón y el argón). Por otra parte, la tabla elaborada por el químico ruso tiene una organización diferente a la que conocemos, en la que ahora situamos elementos juntos en columnas dispuestas en filas.

Tabla periódica actual. / Offnfopt/Wikipedia
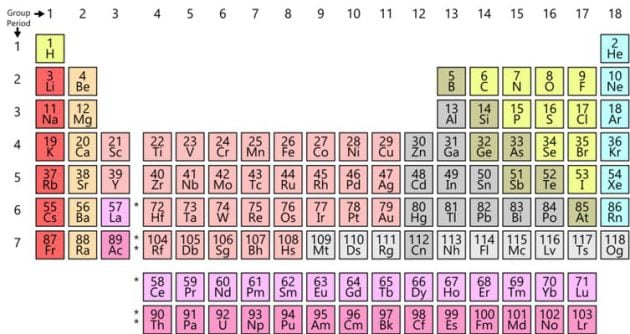
Tabla periódica actual. / Offnfopt/Wikipedia
Pero si se gira la tabla de Mendeléyev 90 grados, la similitud con la versión moderna es evidente. Por ejemplo, los halógenos flúor (F), cloro (Cl), bromo (Br) y yodo (I, representado en la tabla de Mendeléyev con la letra J) aparecen juntos. En la actualidad se encuentran situados en la 17ª columna de la tabla o, como prefieren llamarlo los químicos, el grupo 17.
El período de experimentación
Puede parecer un paso muy pequeño, pero años después de las publicaciones de Mendeléyev se experimentó ampliamente con diseños alternativos para ubicar los diferentes elementos. Incluso antes de que la tabla se estableciera en su disposición actual, había gente sugiriendo algunos giros extraños y maravillosos.
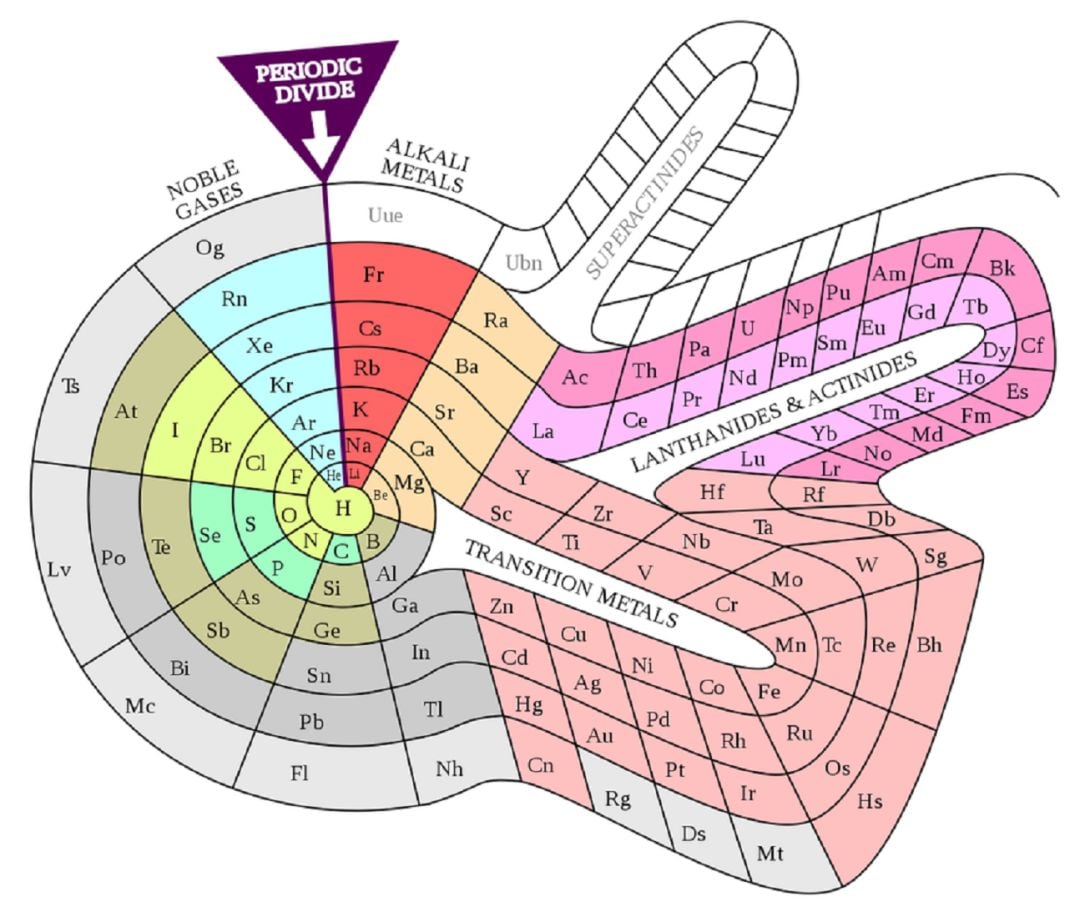
Un ejemplo particularmente llamativo es la espiral de Heinrich Baumhauer, publicada en 1870, en cuyo centro se sitúa el hidrógeno. Los elementos van recorriendo la espiral conforme su masa atómica aumenta, y aquellos que caen en cada radio de la rueda comparten propiedades de la misma manera que lo hacen los elementos que se encuentran en la misma columna (o grupo) de la tabla periódica moderna. No debemos olvidar la extraña aportación de Henry Basset: una tabla con forma de extraña campana.
Sin embargo, a principios del siglo XX la tabla adoptó el formato horizontal que todos conocemos con la sorprendentemente moderna versión que Heinrich Werner diseñó en 1905. Por primera vez, los gases nobles aparecieron en su actual posición, en el extremo derecho de la tabla. Werner trató de imitar las conjeturas de Mendeléyev dejando espacios en blanco, pero se extralimitó en sus pronósticos: sugirió que aparecerían elementos más ligeros que el hidrógeno y emergería uno que tendría su lugar entre el hidrógeno y el helio. Por supuesto, ninguno de los elementos que aventuró Werner existen.
A pesar del moderno aspecto que lucía la tabla, todavía se llevaron a cabo algunas modificaciones necesarias. Es de justicia considerar la versión de Charles Janet como la más influyente. Adoptando un enfoque físico, empleó una teoría cuántica recientemente descubierta en aquellos días para crear un diseño basado en configuraciones de electrones. El resultado fue una tabla escalonada por la izquierda que aún hoy es la preferida por muchos físicos. Curiosamente, Janet también dejó espacio para hasta 120 elementos, a pesar de que en aquel entonces solo se conocían 92. En la actualidad tenemos constancia de la existencia de 118 elementos.
El diseño definitivo
La tabla moderna es una evolución directa de la versión de Janet. Los metales alcalinos (el grupo rematado por el litio) y los metales alcalinotérreos (rematados por el berilio) fueron desplazados desde el extremo derecho hasta el izquierdo, creando una tabla periódica con una forma muy alargada. El problema de este formato es que no encaja en una página o un póster, por lo que debido a razones estéticas los elementos del bloque f son habitualmente recortados y depositados debajo de la tabla principal. Así es como llegamos a la tabla tal y como la conocemos en la actualidad.
Eso no significa que la gente no haya experimentado con otros posibles diseños, a menudo como un intento para remarcar las correlaciones entre elementos que no resultan evidentes en la tabla convencional. Existen, literalmente, cientos de variaciones (puede consultar la base de datos de Mark Leach para comprobarlo), siendo las más populares aquellas en forma de espiral o en 3D, sin olvidar las variantes más irónicas.

Tabla elaborada por el autor del artículo inspirada en el mapa del metro de Londres. / Mark Lorch, Author provided
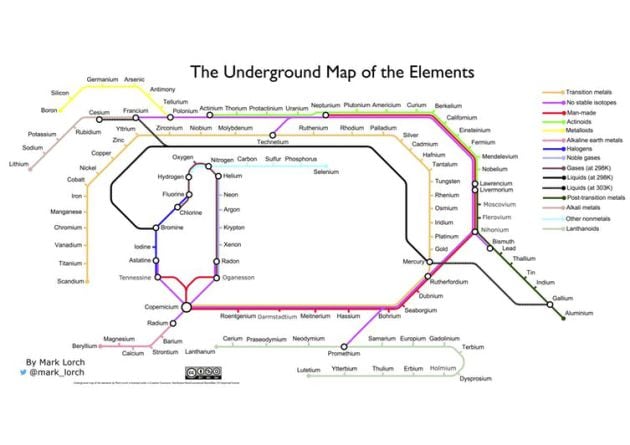
Tabla elaborada por el autor del artículo inspirada en el mapa del metro de Londres. / Mark Lorch, Author provided
¿Qué les parece mi fusión de dos diseños icónicos? ¡La tabla de Mendeléyev y el mapa del metro de Londres de Henry Beck!
Mark Lorch, Professor of Science Communication and Chemistry, University of Hull
Este artículo fue publicado originalmente en The Conversation. Lea el original.






